The Scribble family in cancer: twentieth anniversary.
Santoni MJ, Kashyap R, Camoin L, Borg JP


Le Centre de Recherche en Cancérologie de Marseille fête ses 50 ans ! -
Notre équipe explore les voies de signalisation opérant dans les tumeurs solides. Nous nous concentrons particulièrement sur les composants des réseaux de signalisation qui représentent de nouvelles vulnérabilités encore peu exploitées. Nous étudions leur mode d’action dans les cellules cancéreuses et les mécanismes associés, ainsi que leur implication avec le microenvironnement tumoral. Les études sont réalisées à l’aide de stratégies complémentaires combinant des approches moléculaires, biochimiques et multi-omiques ainsi que cellulaires, complétées par l’utilisation de modèles ex vivo et in vivo récapitulant la complexité du processus tumoral. Nos études bénéficient également de méthodologies interdisciplinaires incluant la biologie computationnelle, la modélisation mathématique et la physique. Nous explorons les voies de signalisation dans les cancers de mauvais pronostic, dès l’initiation de la tumeur et tout au long de sa progression en exploitant des vulnérabilités pour le développement de thérapies ciblées.
Les thèmes de l’équipe s’articulent autour de deux axes principaux :
Nous nous focalisons sur les voies de signalisation peu caractérisées dans le cancer aux niveaux moléculaire et fonctionnel. Il est important de noter que ces signaux représentent de nouvelles cibles potentielles contre lesquelles nous développons des molécules bioactives.
Nous explorons notamment les aspects suivants :
Cet axe explore l’implication de nouveaux gènes/mécanismes impliqués dans le dialogue entre les cellules cancéreuses et leur microenvironnement, en particulier les cellules immunitaires. Notre stratégie est basée sur la combinaison de données provenant de patients et de modèles de cancer ex vivo (organoïdes/tumoroïdes) dérivés d’échantillons tumoraux, étudiés à l’échelle de la cellule unique, et in vivo.
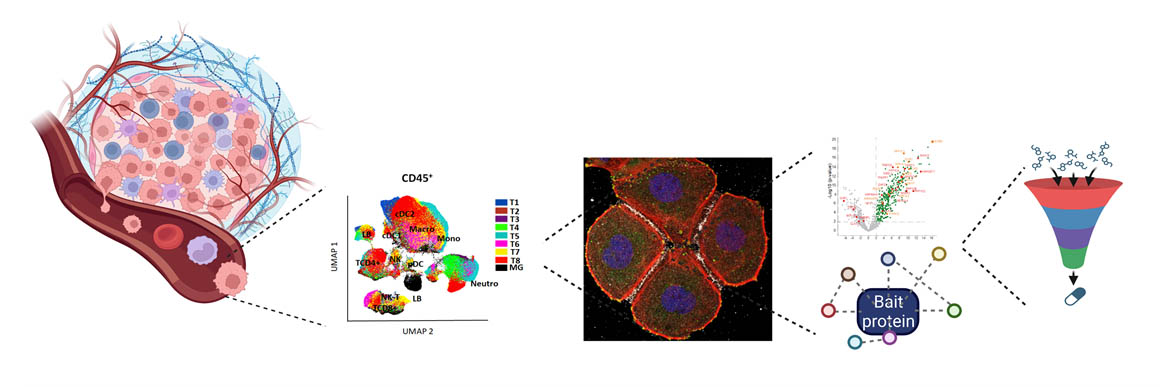 De gauche à droite : Représentation schématique d’une tumeur solide, Clustering cellulaire par UMAP, immunofluorescence cellulaire, interaction protéique (diagramme et réseau), identification des médicaments.
De gauche à droite : Représentation schématique d’une tumeur solide, Clustering cellulaire par UMAP, immunofluorescence cellulaire, interaction protéique (diagramme et réseau), identification des médicaments.
Cet axe se concentre sur des voies de signalisation émergentes dans le cancer, dont les fonctions et les mécanismes d'action restent largement inconnus. Ces voies peuvent représenter de cibles potentielles pour de nouveaux traitements anticancéreux, pour lesquels nous développons des agents bloquants.
Parmi les aspects que nous explorons :
a) Les relations mécanistiques entre les multiples réseaux de signalisation ;
b) La régulation des processus biologiques dans les cellules cancéreuses (initiation, dissémination des cellules, migration collective des cellules, résistance aux traitements, ...) et leur microenvironnement ;
c) La conception de stratégie optimisée pour la génération d'agents bloquants.
La voie de développement WNT/polarité cellulaire planaire (PCP) est la branche la plus récemment décrite de la signalisation WNT et est fortement impliquée dans le développement du cancer à des stades précoces et tardifs. Au fil des ans, nous avons effectué des travaux fondamentaux sur le mode d'action et le rôle de la signalisation WNT/PCP dans les cancers agressifs et nous avons récemment passé en revue les stratégies les plus prometteuses actuellement conçues pour cibler ses composants membranaires ou sub-membranaires. En outre, nous avons montré que ADAMTSL5, une protéine secrétée qui interagit avec des partenaires moléculaires encore peu connus, est surexprimée dans différents types de cancer de mauvais pronostic, représentant une nouvelle cible thérapeutique.
Nous étudions en particulier les molécules suivantes :
1.1. VANGL2 est un récepteur de la voie WNT/PCP doté de quatre régions transmembranaires, de deux boucles extracellulaires et de deux régions intracellulaires. Nous avons constaté que la surexpression de VANGL2 dans le cancer du sein triple-négatif (TNBC) est en corrélation avec un mauvais pronostic. Le mode d'action de VANGL2 reste encore énigmatique malgré les données accumulées par différentes équipes dont la nôtre. Nous avons récemment co-purifié VANGL2 avec un récepteur couplé à une protéine G (GPCR) de la voie WNT/PCP. Les connaissances actuelles sur l'expression, la fonction et la signalisation en aval de ce GPCR en physiologie et dans les tumeurs malignes sont plutôt limitées. Néanmoins, une analyse transcriptomique sur une large cohorte de patientes de l’Institut Paoli-Calmettes (IPC) atteintes de TNBC et de données publiques a montré une association entre la surexpression de ce GPCR et la diminution de la survie sans métastases, avec un effet synergique de VANGL2.
Actuellement, nous :
1) étudions l'organisation moléculaire du complexe de la voie VANGL2/GPCR et sa contribution à l'agressivité du TNBC ;
2) développons des anticorps capables de détecter la forme active du GPCR dans des coupes de tissus provenant de TNBC (Tissu MicroArray, > 250 biopsies, IPC) pour des études de corrélation clinique ;
3) disséquons la signalisation en aval du GPCR et l'impact de VANGL2 dans des cellules normales et cancéreuses mammaires, en utilisant différentes méthodes de transfert d'énergie (BRET/FRET) ;
4) produisons des modulateurs pharmacologiques influant sur les fonctions pro-tumorigéniques du GPCR.
1.2. MINK1, une sérine-thréonine kinase de la voie WNT/PCP qui favorise la croissance tumorale et la dissémination des cellules cancéreuses du cancer du sein pour former des métastases (par exemple Project(s) - FRENCH A more detailed text where you can provide information about your project(s). Les membres de la famille de protéines kinases proches de MINK1 régulent également les signaux WNT, HIPPO et AKT.
Nous sommes actuellement en train de :
1) développer des inhibiteurs de MINK1 à usage thérapeutique ;
2) générer des biomarqueurs capables de prédire l’efficacité des inhibiteurs de MINK1 ;
3) disséquer la signalisation MINK1 par des approches de spectrométrie de masse ;
4) évaluer les inhibiteurs de MINK1 dans un modèle murin du TNBC génétiquement modifié ainsi que dans des modèles "Patient Derived Xenografts" (PDX) ou tumoroïdes de TNBC dérivés de patientes.
1.3. PTK7 est un récepteur pseudo-tyrosine kinase surexprimé dans de nombreux types de cancer, associé à un mauvais pronostic et à une dissémination métastatique. PTK7 joue un double rôle dans les voies WNT/PCP et WNT/β-caténine en se liant directement à la β-caténine. Ce récepteur est actuellement ciblé par un conjugué anticorps-médicament (ADC) qui a donné des résultats prometteurs. Nous avons récemment développé de petites molécules capables d'inhiber l'interaction entre PTK7 et β-caténine.
Actuellement, nous :
1) déployons une approche holistique de recherche de molécules inhibitrices en étudiant les relations structure-activité ;
2) évaluons l'efficacité des composés sélectionnés in vitro et in vivo dans le cancer colorectal.
1.4. ADAMTSL5 est l'un des gènes issus des criblages que nous avons réalisés, qui n'a jamais été impliqué dans le cancer avant nos études. ADAMTSL5 est une glycoprotéine sécrétée, dépourvue d'activité catalytique, et caractérisée par un domaine Nétrine situé dans la région C-terminale absent dans d'autres membres de la famille. Nous avons documenté son implication dans le carcinome hépatocellulaire (CHC) et montré que son inhibition conduit à une perte d'un état hybride épithélial[1]mésenchymateux, caractérisant l’agressivité, et à l’acquisition d’un état fibroblastique. Le ciblage de l’expression de l'ADAMTSL5 conduit à une déplétion de plusieurs oncogènes, y compris de récepteurs à activité tyrosine kinase (RTKs), interfère avec les propriétés tumorales des cellules cancéreuses et confère une sensibilité aux médicaments utilisés en clinique.
Nous sommes actuellement en train de :
1) confirmer ADAMTSL5 en tant que biomarqueur ;
2) décrypter le complexe protéique associé à ADAMTSL5 et son mécanisme d’action ;
3) étudier comment ADAMTSL5 impacte le microenvironnement tumoral, en particulier le système immunitaire ;
4) générer des agents pour le diagnostic et le ciblage d’ADAMTSL5 (anticorps, aptamères ,…).
Cet axe vise à explorer l'implication de nouveaux gènes/mécanismes candidats dans le dialogue entre les cellules cancéreuses et leur microenvironnement, en particulier avec les cellules immunitaires. Il est basé sur la combinaison d'ensembles de données et d'échantillons provenant de patients avec des modèles de cancer ex vivo (organoïdes/tumoroïdes), à cellule unique et spatiaux, et in vivo.
2.1. En nous concentrant sur le TNBC, nous utilisons des modèles uniques de cancer in vivo pour explorer la composition des différents types de cellules immunitaires présent dans le microenvironnement tumoral et leur interaction avec les cellules cancéreuses. Nous reconstituons et ciblons ces interactions in vivo en développant des modèles orthotopiques chez des souris syngéniques dont le système immunitaire est intact. Les résultats sont systématiquement comparés aux contextes observés chez les patients. En outre, nous explorons longitudinalement comment des traitements anticancéreux distincts peuvent conduire à un remodelage immunitaire spécifique, ceci en fonction du type de traitement. Ces études sont réalisées avec des analyses dynamiques plutôt que statiques, afin de comprendre comment le remodelage immunitaire peut influencer le choix le plus pertinent des immunothérapies. Nous anticipons que l’acquisition de ces connaissances pourront aider à la conception de nouvelles combinaisons d'agents anticancéreux et d'immunothérapies.
2.2. Nous avons rassemblé une série de données préliminaires indiquant que les lésions tumorales précoces sont caractérisées par des caractéristiques cellulaires et moléculaires qui diversifient leur comportement au fil du temps (quiescent versus évolutif). En nous concentrant sur le cancer du foie, nous étendons ces études en utilisant des modèles murins uniques de tumorigenèse spontanée, récapitulant l'hétérogénéité moléculaire ainsi que temporelle de l'apparition de la tumeur. Nous avons documenté la possibilité d'utiliser la tomographie assistée par ordinateur à comptage de photons (PC-CT ; établie par nos collaborateurs en physique du CPPM) pour suivre longitudinalement les tumeurs endogènes. Les lésions quiescentes et évolutives sont analysées par cytométrie spectrale et par single cell RNAseq, afin de découvrir les caractéristiques moléculaires et cellulaires qui diversifient un comportement évolutif ou quiescent des lésions pré-néoplasiques. Nous évaluons la robustesse des résultats sur le plan fonctionnel à l’aide de modèles ex vivo et in vivo, et sur le plan clinique en analysant des données et des échantillons de patients.
2.3. Rôle de la PTK7 dans les interactions entre la tumeur et l'hôte. Nous avons récemment découvert que PTK7 est exprimée dans les cellules dendritiques (DC), en particulier les cellules de Langerhans (peau, ganglions lymphatiques cutanés) chez la souris. En outre, l'expression de PTK7 a également été observée dans les monocytes infiltrant la tumeur, les pDC, les cDC2 et les cDC1 dans les modèles murins de mélanome et de cancer du sein, ce qui suggère que PTK7 peut être modulé par le microenvironnement tissulaire.
En utilisant un modèle de souris unique et des données -omiques multiparamétriques, nous :
1) étudions la fonction physiologique de PTK7 dans les cellules dendritiques (DC) ;
2) déterminons le rôle des DC exprimant PTK7 dans le cancer du sein. Nous avons identifié l'expression de PTK7 dans les fibroblastes du côlon et des niveaux accrus dans le CCR murin et humain. Nous avons généré des souris déficientes en PTK7 dans un sous-ensemble de fibroblastes du côlon et révélé une susceptibilité à la colite aiguë et à une probable tumorigenèse.
Ces résultats indiquent un rôle essentiel de PTK7 dans le dialogue entre l'épithélium colique et les fibroblastes. Nous sommes actuellement en train de :
1) documenter l’implication de PTK7 dans le dialogue entre l'épithélium colique et les fibroblastes pendant l’homéostasie du tissu ;
2) caractériser moléculairement et fonctionnellement des différents compartiments cellulaires régulés par PTK7 à l'aide de modèles murins pertinents et d'organoïdes humains ;
3) déterminer les partenaires de liaison de PTK7 dans les compartiments épithéliaux et fibroblastiques en utilisant un modèle de souris "knock-in" PTK7-BirA* dans la carcinogenèse du côlon ;
4) déchiffrer la contribution des fibroblastes exprimant PTK7 dans la tumorigenèse du cancer du côlon ;
5) valider l'expression de PTK7 et les altérations identifiées chez la souris en tant que marqueurs pronostiques chez les patients atteints de cancer du côlon.
Santoni MJ, Kashyap R, Camoin L, Borg JP
Daulat AM, Finetti P, Revinski D, Silveira Wagner M, Camoin L, Audebert S, Birnbaum D, Kodjabachian L, Borg JP, Bertucci F
Lopez Almeida L, Sebbagh M, Bertucci F, Finetti P, Wicinski J, Marchetto S, Castellano R, Josselin E, Charafe-Jauffret E, Ginestier C, Borg JP, Santoni MJ
Puvirajesinghe TM, Bertucci F, Jain A, Scerbo P, Belotti E, Audebert S, Sebbagh M, Lopez M, Brech A, Finetti P, Charafe-Jauffret E, Chaffanet M, Castellano R, Restouin A, Marchetto S, Collette Y, Gonçalvès A, Macara I, Birnbaum D, Kodjabachian L, Johansen T, Borg JP
Rochigneux P, Lisberg A, Garcia A, Granjeaud S, Madroszyk A, Fattori S, Gonçalves A, Devillier R, Maby P, Salem N, Gorvel L, Chanez B, Gukasyan J, Carroll J, Goldman J, Chretien AS, Olive D, Garon EB
Montserrat-Gomez M, Gogl G, Carrasco K, Betzi S, Durbesson F, Cousido-Siah A, Kostmann C, Essig DJ, Strømgaard K, Østergaard S, Morelli X, Trave G, Vincentelli R, Bailly E, Borg JP